مرور کلی (Overview)
تحویل محصولات استریل برای استفاده در مراقبت از بیمار، تنها به اثربخشی فرآیند استریلیزاسیون وابسته نیست، بلکه به عوامل متعددی از جمله طراحی واحد، رفع آلودگی، باز کردن قطعات و بستهبندی وسیله، نحوه بارگذاری استریلیزاتور، پایش فرآیند، کیفیت و مقدار ماده استریلکننده، مناسببودن سیکل استریلیزاسیون با محتوای بار، و سایر جنبههای بازفرآوری تجهیزات نیز بستگی دارد. کارکنان حوزه سلامت باید بیشتر عملیات شستوشو، ضدعفونی و استریلیزاسیون ملزومات مراقبت از بیمار را در واحد مرکزی پردازش (Central Processing Department) انجام دهند تا کنترل کیفیت آسانتر و مؤثرتر صورت گیرد.
هدف از پردازش مرکزی، انجام منظم فرآیند آمادهسازی ابزارهای پزشکی و جراحی برای محافظت از بیماران در برابر عفونتها، همزمان با کاهش خطرات برای کارکنان و حفظ ارزش اقلامی است که مجدداً پردازش میشوند. مراکز درمانی باید همان سطح از کارایی و ایمنی که در واحد پردازش مرکزی رعایت میشود را در آمادهسازی تجهیزات در سایر بخشها (مانند اتاق عمل و درمانهای تنفسی) نیز ترویج دهند.
یکنواختی در روشهای استریلیزاسیون
اطمینان از یکنواختی در شیوههای استریلیزاسیون مستلزم وجود یک برنامه جامع است که شایستگی اپراتورها و اجرای صحیح روشهای شستوشو و بستهبندی ابزارها، بارگذاری استریلیزاتور، کار با دستگاه و پایش کل فرآیند را تضمین کند. علاوه بر این، از دیدگاه پیشگیری از عفونت، مراقبتها باید در تمامی محیطهای ارائه خدمات به بیمار، از جمله بیمارستانها و مراکز سرپایی، بهصورت یکنواخت انجام شوند.
تأیید سیکل استریلیزاسیون (Sterilization Cycle Verification)
فرآیند استریلیزاسیون باید پیش از بهکارگیری در مراکز درمانی مورد تأیید قرار گیرد. تمامی استریلیزاتورهای بخار، اتیلن اکساید (ETO) و سایر استریلیزاتورهای دمای پایین، هنگام نصب، جابهجایی، طراحی مجدد، پس از تعمیرات اساسی و همچنین پس از بروز شکست در فرآیند استریلیزاسیون، با استفاده از شاخصهای بیولوژیک و شیمیایی آزمایش میشوند تا از عملکرد صحیح آنها پیش از استفاده روتین اطمینان حاصل شود.
برای این منظور، سه سیکل متوالی بخار بدون بار با استفاده از شاخصهای بیولوژیک و شیمیایی در یک بسته یا سینی آزمون مناسب اجرا میشود. هر نوع سیکل بخار مورد استفاده برای استریلیزاسیون (مانند سیکل وکیومدار یا ثقلی) باید بهصورت جداگانه آزمایش شود. در استریلیزاتورهای بخار پیشوکیوم، سه سیکل متوالی بدون بار همراه با آزمون Bowie-Dick نیز اجرا میشود. استریلیزاتور تا زمانی که تمامی شاخصهای بیولوژیک منفی و شاخصهای شیمیایی نشاندهنده پاسخ نهایی صحیح باشند، مجدداً وارد چرخه استفاده نمیشود.
پایش مستمر کیفیت
آزمایش شاخصهای بیولوژیک و شیمیایی همچنین بهمنظور تضمین کیفیت مستمر، بر روی نمونههای نماینده از محصولات واقعی که در حال استریلیزاسیون هستند انجام میشود و نیز زمانی که تغییرات اساسی در بستهبندی، لفافها یا پیکربندی بار ایجاد میگردد. شاخصهای بیولوژیک و شیمیایی در داخل محصولات قرار داده شده و این محصولات در یک بار کامل پردازش میشوند.
زمانی که سه سیکل متوالی نتایج منفی شاخص بیولوژیک و پاسخ نهایی صحیح شاخص شیمیایی را نشان دهند، تغییر اعمالشده میتواند وارد استفاده روتین شود. اقلامی که طی این سه سیکل ارزیابی پردازش شدهاند باید تا زمان منفی شدن نتایج آزمونها در قرنطینه نگهداری شوند.
امکانات فیزیکی (Physical Facilities)
بهطور ایدهآل، بخش(های) پردازش مرکزی باید حداقل به سه ناحیه مجزا تقسیم شوند:
- رفع آلودگی (Decontamination)
- بستهبندی (Packaging)
- استریلیزاسیون و انبارش (Sterilization and Storage)
برای محدود کردن آلودگی اقلام مصرفشده، باید موانع فیزیکی ناحیه رفع آلودگی را از سایر بخشها جدا کنند. در ناحیه رفع آلودگی، تجهیزات قابل استفاده مجددِ آلوده (و در برخی موارد اقلام یکبارمصرفی که مجدداً استفاده میشوند) دریافت، تفکیک و رفع آلودگی میگردند.
الگوی جریان هوای توصیهشده باید بهگونهای باشد که آلایندهها را در محدوده ناحیه رفع آلودگی نگه داشته و انتقال آنها به نواحی تمیز را به حداقل برساند. مؤسسه آمریکایی معماران (American Institute of Architects) استفاده از فشار منفی و حداقل شش تعویض هوا در ساعت را برای ناحیه رفع آلودگی توصیه میکند (در حالیکه AAMI تعداد ۱۰ تعویض هوا در ساعت را پیشنهاد میدهد). همچنین در اتاق تجهیزات استریلیزاسیون، ۱۰ تعویض هوا در ساعت همراه با فشار مثبت توصیه شده است.
ناحیه بستهبندی برای بازرسی، مونتاژ و بستهبندی اقلام تمیز، اما غیر استریل، در نظر گرفته میشود. ناحیه انبارش اقلام استریل باید دارای دسترسی محدود بوده و از دمای کنترلشده (که میتواند تا حدود ۷۵ درجه فارنهایت باشد) و رطوبت نسبی کنترلشده برخوردار باشد. رطوبت نسبی در تمامی نواحی کاری بهجز انبار استریل باید بین ۳۰ تا ۶۰ درصد باشد و در ناحیه انبارش اقلام استریل نباید از ۷۰ درصد تجاوز کند.
کفها و دیوارها باید از موادی ساخته شوند که در برابر عوامل شیمیایی مورد استفاده برای شستوشو یا ضدعفونی مقاوم باشند. سقفها و سطوح دیوار نیز باید از موادی ساخته شوند که ذرات معلق یا ریزش نداشته باشند. چیدمان فیزیکی نواحی پردازش در چهار منبع مرجع بهصورت شماتیک ارائه شده است.
شستوشو (Cleaning)

همانطور که بارها اشاره شده است، اقلام پیش از انجام فرآیندهای بعدی باید با استفاده از آب به همراه شویندهها یا پاککنندههای آنزیمی تمیز شوند. شستوشو باعث کاهش بار میکروبی شده و مواد خارجی (مانند باقیماندههای آلی و نمکهای معدنی) را که با ایجاد مانع، در فرآیند استریلیزاسیون اختلال ایجاد میکنند، حذف مینماید. ابزارهای جراحی معمولاً برای جلوگیری از خشک شدن خون و بافت، پیشخیس (Presoak) یا پیششستوشو (Prerinse) میشوند.
در مورد اقلامی که بهشدت با مدفوع، خلط، خون یا سایر مواد آلوده شدهاند، ممکن است انجام پیشتمیزکاری در محل ارائه مراقبت به بیمار ضروری باشد. ارسال اقلام به واحد پردازش مرکزی بدون حذف آلودگیهای درشت میتواند شستوشوی آنها را به دلیل خشک شدن ترشحات و دفعیات دشوار سازد. شستوشو و رفع آلودگی باید در کوتاهترین زمان ممکن پس از استفاده از اقلام انجام گیرد.
انواع مختلفی از دستگاههای شستوشوی مکانیکی (مانند ماشین شستوشو–ضدعفونی ظروف، پاککننده اولتراسونیک، شستوشو–استریلیزاتور، ماشین ظرفشویی، و شستوشو–ضدعفونیکننده) میتوانند فرآیند شستوشو و رفع آلودگی اکثر اقلام را تسهیل کنند. این تجهیزات اغلب خودکار بوده و میتوانند بهرهوری را افزایش دهند، اثربخشی شستوشو را بهبود بخشند و مواجهه کارکنان با خون و مایعات بدن را کاهش دهند.
اشیای ظریف و پیچیده و اقلام حساس به حرارت یا رطوبت ممکن است نیازمند شستوشوی دستی با دقت بالا باشند. تمامی اقلام مصرفشدهای که به واحد پردازش مرکزی ارسال میشوند باید آلوده تلقی شوند (مگر آنکه در محل استفاده رفع آلودگی شده باشند)، با دستکش جابهجا شوند (در برخی موارد برای جلوگیری از تماس با وسایل نوکتیز، استفاده از پنس یا انبر ضروری است) و از طریق یکی از روشهای ذکرشده رفع آلودگی شوند تا ایمنتر برای دستکاری باشند.
اقلامی که دارای بیش از یک قطعه قابل جداسازی هستند باید باز شوند. همچنین باید دقت شود که تمامی قطعات با هم نگه داشته شوند تا مونتاژ مجدد بهصورت کارآمد انجام گیرد.
پژوهشگران میزان تمیزی را از طریق بررسی چشمی و میکروسکوپی توصیف کردهاند. در یک مطالعه مشخص شد که ۹۱٪ ابزارها از نظر چشمی تمیز به نظر میرسیدند، اما در بررسی میکروسکوپی، ۸۴٪ آنها دارای بقایای آلودگی بودند. محلهای باقیماندن آلودگی شامل نواحی اتصال بین غلافهای عایق و مکانیزمهای فعالکننده ابزارهای لاپاروسکوپی و نیز مفاصل و شیارهای پنسها بود. برای درک اهمیت بالینی این یافتهها و چگونگی تضمین شستوشوی صحیح، به پژوهشهای بیشتری نیاز است.
کارکنانی که در ناحیه رفع آلودگی فعالیت میکنند باید هنگام دستکاری یا شستوشوی ابزارها و تجهیزات آلوده، از دستکشهای لاستیکی یا پلاستیکی مشابه دستکشهای نظافت خانگی استفاده کنند. در مواقعی که احتمال تماس با خون و مایعات آلوده وجود دارد (مانند شستوشوی دستی تجهیزات آلوده)، استفاده از ماسک صورت، محافظ چشم مانند عینک یا شیلد کامل صورت، و گان مناسب ضروری است. ابزارهای آلوده منبع میکروارگانیسمهایی هستند که میتوانند از طریق پوست آسیبدیده دستها یا تماس با مخاط چشم، بینی یا دهان، کارکنان را آلوده کنند.
وسایل نوکتیز قابل استفاده مجدد که با خون تماس داشتهاند، خطر ویژهای دارند. کارکنان نباید برای برداشتن این وسایل، دستکشپوش دست خود را داخل سینیها یا ظروف حاوی وسایل نوکتیز فرو ببرند. در عوض، باید از کنترلهای مهندسی مانند پنس برای خارج کردن این وسایل استفاده شود.
بستهبندی (Packaging)
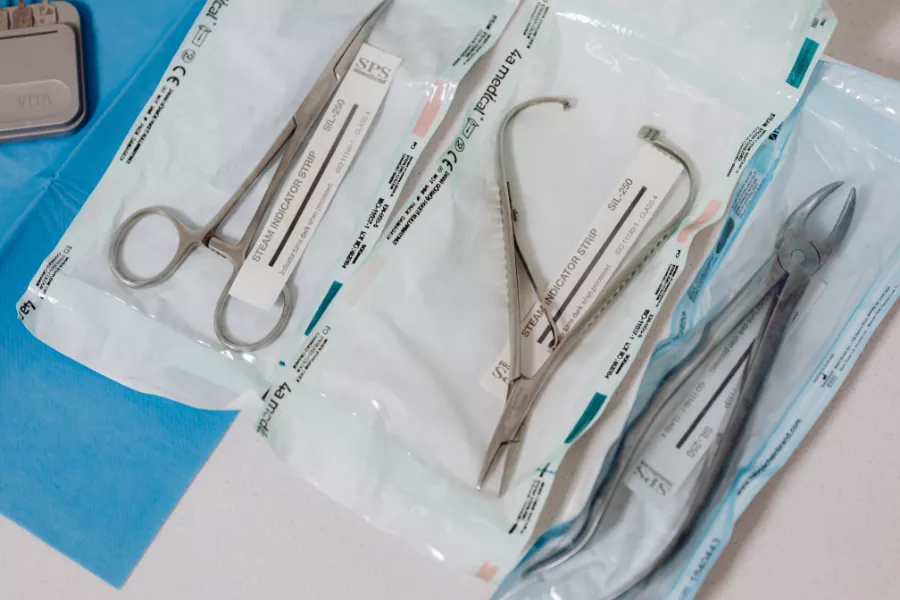
پس از آنکه اقلام شسته، خشک و بازرسی شدند، آن دسته از اقلامی که نیاز به استریلیزاسیون دارند باید لفافپیچی شده یا در کانتینرهای سخت قرار گیرند و طبق دستورالعملهای ارائهشده توسط AAMI و سایر سازمانهای حرفهای، در سینیها یا سبدهای ابزار چیده شوند. بر اساس این دستورالعملها:
- ابزارهای لولادار باید در وضعیت باز قرار گیرند؛
- اقلام دارای قطعات جداشدنی باید باز شوند، مگر آنکه سازنده دستگاه یا دادههای پژوهشی دستورالعمل متفاوتی ارائه کرده باشند؛
- ابزارهای پیچیده باید مطابق با دستورالعملها و دادههای آزمون سازنده آمادهسازی و استریل شوند؛
- تجهیزات دارای سطوح مقعر باید بهگونهای قرار داده شوند که تخلیه آب بهخوبی انجام شود؛
- اقلام سنگین باید طوری چیده شوند که به اقلام ظریف آسیب نزنند؛
- وزن مجموعه ابزار باید بر اساس طراحی، تراکم ابزارها و توزیع جرم فلزی تعیین شود.
اگرچه دیگر حد وزن مشخصی برای ستهای جراحی در نظر گرفته نمیشود، جرم فلزی بالا یکی از علل ایجاد بستههای خیس (Wet Packs) است؛ یعنی باقیماندن رطوبت در داخل کیس یا سینی پس از پایان سیکل استریلیزاسیون. سایر عواملی که میتوانند بر خشک شدن تأثیر بگذارند شامل تراکم لفافها و طراحی ست ابزار هستند.
روشهای مختلفی برای حفظ استریلیتی ابزارهای جراحی وجود دارد که شامل کانتینرهای سخت، پاکتهای بازشونده (Peel-open) مانند پاکتهای پلاستیکی–کاغذی خودچسب یا حرارتی، رولها یا ریلها (ترکیبات لولهای کاغذ–پلاستیک که کاربر میتواند آنها را برش داده و دو سر آن را دوخت کند) و لفافهای استریلیزاسیون (بافته و نبافته) میباشند. مراکز درمانی میتوانند از تمام این گزینهها استفاده کنند.
مواد بستهبندی باید امکان نفوذ عامل استریلکننده را فراهم کنند، در حین جابهجایی از آلودگی تماسی محافظت نمایند، سد مؤثری در برابر نفوذ میکروبی ایجاد کنند و استریلیتی اقلام فرآوریشده را پس از استریلیزاسیون حفظ نمایند. لفاف ایدهآل استریلیزاسیون باید معیارهایی مانند اثربخشی سد، نفوذپذیری، تهویه (مانند خروج ETO)، سهولت استفاده، انعطافپذیری، مقاومت در برابر سوراخشدن و پارگی، سمیت، بو، دفع پسماند، پرزدهی، هزینه و شفافیت را بهخوبی پوشش دهد.
بستهبندیهای نامناسب برای استفاده با اتیلن اکساید (مانند فویل، PVC و پوششهای شفاف خانگی) یا پلاسما گاز پراکسید هیدروژن (مانند پارچهها و کاغذ) نباید برای بستهبندی اقلام پزشکی مورد استفاده قرار گیرند.
در واحد پردازش مرکزی، دولایهپیچی (Double Wrapping) میتواند بهصورت متوالی یا غیرمتوالی (همزمان) انجام شود. بستهبندی باید بهگونهای انجام گیرد که از ایجاد فضای خیمهای (Tenting) و شکاف (Gapping) جلوگیری شود. در روش متوالی، از دو لایه لفاف استاندارد استفاده میشود که یکی پس از دیگری پیچیده میشوند و در واقع یک بسته درون بسته ایجاد میگردد. در روش غیرمتوالی، دو لایه لفاف بهطور همزمان پیچیده میشوند و فرآیند بستهبندی تنها یکبار انجام میشود. این روش علاوه بر ایجاد چندین لایه محافظتی در برابر آلودگی، باعث صرفهجویی در زمان نیز میشود.
با وجود بهبود اثربخشی سد یک لایه لفاف در سالهای اخیر، استفاده از چندین لایه همچنان به دلیل شرایط سخت جابهجایی در مراکز درمانی رویهای رایج است. دستورالعملهای مکتوب و مصور برای آمادهسازی اقلام جهت بستهبندی باید بهراحتی در دسترس کارکنان بوده و هنگام انجام فرآیند بستهبندی مورد استفاده قرار گیرند.
بارگذاری (Loading)
تمام اقلامی که قرار است استریل شوند باید بهگونهای چیده شوند که تمام سطوح آنها مستقیماً در معرض عامل استریلکننده قرار گیرد. بنابراین روشهای بارگذاری باید امکان گردش آزاد بخار (یا سایر استریلانتها) را در اطراف هر قلم فراهم کنند. در گذشته توصیه میشد بستههای پارچهای موسلین از نظر ابعاد، وزن و چگالی از حدود ۱۲×۱۲×۲۰ اینچ، ۱۲ پوند و ۷٫۲ پوند بر فوت مکعب تجاوز نکنند. اما به دلیل تنوع زیاد منسوجات و کانتینرهای فلزی/پلاستیکی موجود در بازار، باید برای آمادهسازی بستهها و پارامترهای چگالی، از راهنمای تولیدکننده منسوجات/کانتینر و نیز تولیدکننده استریلایزر استفاده شود.
اصول پایه بارگذاری استریلایزر شامل این موارد است:
- گردش مناسب استریلانت حفظ شود؛
- سینیهای سوراخدار طوری قرار گیرند که موازی قفسه باشند؛
- ظروف بدون سوراخ (مثل لگنها) به صورت ایستاده روی لبه قرار گیرند؛
- اقلام کوچک شل و غیر فشرده داخل سبدهای سیمی گذاشته شوند؛
- پکهای «Peel» به صورت ایستاده در رکها/سبدهای کف توری یا سوراخدار قرار داده شوند.
2) نگهداری (Storage)
مطالعات دهه ۱۹۷۰ نشان دادند که استریل ماندن سینیهای جراحیِ لفافپیچیشده، بسته به نوع لفاف و شرایط نگهداری (مثلاً قفسه باز یا کمد بسته) متفاوت است. زمان نگهداری ایمن به تخلخل لفاف و شرایط انبار وابسته است. گزارش شده است که پاکتهای پلاستیکیِ «peel-down» با دوخت حرارتی و نیز پکهایی که بعد از استریلیزاسیون در پوشش پلیاتیلن ۳ میلی (۳/۱۰۰۰ اینچ) سیل میشوند، میتوانند تا ۹ ماه استریل بمانند.
این روکش پلیاتیلن پس از استریلیزاسیون برای افزایش عمر قفسهای اقلام کممصرف استفاده میشود. اقلامی که با موسلین دولایه (چهار لایه) یا معادل آن بستهبندی شوند، حداقل ۳۰ روز استریل میمانند. هر قلم استریلشده اگر از تاریخ انقضا گذشته باشد، یا بسته آن خیس، پاره یا سوراخ شده باشد، نباید استفاده شود.
با اینکه برخی بیمارستانها همچنان روی «عمر قفسهای زمانمحور» (Time-related) تاریخ میزنند، بسیاری به سمت «عمر قفسهای رویدادمحور» (Event-related) رفتهاند؛ یعنی محصول تا زمانی استریل محسوب میشود که رویدادی باعث آلودگی شود (مثل پارگی بسته، خیس شدن، شکستن پلمب).
عوامل رویدادمحور مؤثر در آلودگی شامل: بار میکروبی محیط، جریان هوا، رفتوآمد، محل قرارگیری، رطوبت، حشرات/جوندگان، سیلاب، فضای انبار، قفسه باز/بسته، دما و ویژگیهای لفاف است. دادههایی از رویکرد رویدادمحور حمایت میکنند و نشان میدهند آلودگی الزاماً با گذشت زمان افزایش منظم ندارد (بهویژه در انبار پوشیده). همچنین احتمال آلودگی با افزایش دستکاری و جابهجایی بیشتر میشود.
پس از استریلیزاسیون، تجهیزات باید با تکنیک آسپتیک جابهجا شوند تا آلودگی ایجاد نشود. اقلام استریل باید با فاصله مناسب از کف (۸ تا ۱۰ اینچ)، سقف (۵ اینچ؛ مگر نزدیک اسپرینکلر که باید ۱۸ اینچ فاصله داشته باشد) و دیوارهای خارجی (۲ اینچ) نگهداری شوند تا گردش هوا، نظافت و رعایت کدهای آتشنشانی ممکن باشد. تجهیزات پزشکی نباید زیر سینک یا جاهایی نگهداری شوند که امکان خیس شدن دارند.
اقلام استریلِ خیس آلوده محسوب میشوند، چون رطوبت میتواند میکروارگانیسمها را از هوا و سطوح منتقل کند. کابینتهای بسته/پوشیده ایدهآل هستند ولی قفسه باز هم ممکن است استفاده شود. هر بستهای که روی زمین افتاده باید از نظر آسیب بستهبندی و محتوا (خصوصاً اقلام شکننده) بررسی شود. اگر بسته در پلاستیک نفوذناپذیر با دوخت حرارتی باشد و پلمب سالم باشد، معمولاً آلوده تلقی نمیشود؛ و اگر آسیبی نداشته باشد، اقلام بستهبندیشده در پلاستیک لزوماً نیاز به بازفرآوری مجدد ندارند.
3) پایش (Monitoring)
فرآیند استریلیزاسیون باید بهطور روتین با ترکیبی از شاخصهای مکانیکی، شیمیایی و بیولوژیک پایش شود تا شرایط استریلکننده و بهصورت غیرمستقیم وضعیت میکروبی اقلام ارزیابی گردد.
- پایش مکانیکی استریل بخار شامل بررسی روزانه زمان سیکل و دما (با نمودار ثبت دما یا پرینت کامپیوتری) و نیز ارزیابی فشار از طریق گیج فشار است.
- در ETO، رکوردرهای زمان/دما/فشار دادهها را از طریق پرینت، گیج یا نمایشگر ارائه میدهند؛ اما معمولاً دو مؤلفه مهم (غلظت گاز و رطوبت) در استریلایزرهای ETO درمانگاهی بهسادگی قابل پایش نیست.
اندیکاتورهای شیمیایی ارزان و راحتاند و نشان میدهند قلم در معرض فرآیند قرار گرفته است؛ اما اثبات قطعی استریلیتی نمیکنند و ممکن است در زمانهای مرزی بهاشتباه «قبول» بدهند. بنابراین باید همراه با اندیکاتورهای بیولوژیک استفاده شوند نه بهعنوان جایگزین. اندیکاتور شیمیایی باید بیرون هر بسته نصب شود و ترجیحاً داخل بسته هم قرار گیرد تا نفوذ استریلانت را نشان دهد.
این اندیکاتورها معمولاً جوهرهای حساس به حرارت یا مواد شیمیایی هستند که با وجود پارامترهای مشخص (مثل زمان/دما/بخار اشباع یا پارامترهای ETO) تغییر رنگ میدهند و در پنج کلاس دستهبندی میشوند. اگر اندیکاتور داخلی یا خارجی نشاندهنده فرآیند ناکافی باشد، آن قلم نباید استفاده شود. در استریلایزرهای بخارِ پیشوکیوم/حذف هوای دینامیک، تست حذف هوا (Bowie-Dick) باید روزانه در محفظه خالی انجام شود.
اندیکاتورهای بیولوژیک از نظر بسیاری از مراجع، نزدیکترین ابزار به پایش ایدهآل هستند، چون با استفاده از مقاومترین میکروارگانیسمها (اسپورهای باسیلوس) قدرت کشندگی فرآیند را مستقیماً میسنجند. اگر اندیکاتور بیولوژیک غیرفعال شود، بهطور قوی نشان میدهد سایر پاتوژنهای احتمالی هم از بین رفتهاند.
اسپورهای رایج:
- B. atrophaeus (حدود ۱۰^۶ اسپور) برای ETO و حرارت خشک؛ انکوباسیون ۳۵–۳۷°C
- G. stearothermophilus (حدود ۱۰^۵ اسپور) برای بخار، پلاسما گاز پراکسید هیدروژن و استریلایزرهای مایع پراستیک اسید؛ انکوباسیون ۵۵–۶۰°C
نکته:
جهت خرید پراستیک اسید گرید دارویی با کارشناسان فروش شهرشیمی در تماس باشید.
پایش هفتگی حداقل برای بخار و استریلهای دمای پایین توصیه میشود؛ و اگر دستگاه زیاد استفاده میشود، پایش روزانه کمک میکند خرابیها زودتر کشف شوند. هر بارِ شامل ایمپلنت باید پایش شود و در صورت امکان تا منفی شدن نتیجه اسپور، ایمپلنت استفاده نشود.
اندیکاتورهای بیولوژیک قدیمی ممکن بود تا ۷ روز زمان انکوباسیون نیاز داشته باشند. نسل بعدی «خودمحتوی» زمان را تا ۴۸ ساعت کاهش داد و بسیاری از شکستها تا ۲۴ ساعت قابل تشخیص بودند. اندیکاتورهای خوانش سریع (فلورسنت) برای بخار سالهاست وجود دارد و نتایج سریع آنها با نتایج کشتهای ۲۴–۴۸ ساعته و ۷ روزه همخوانی خوبی نشان میدهد. برای ETO نیز اندیکاتور خوانش سریعِ تأییدشده (از جمله توسط FDA در آمریکا) طراحی شده است که بر اساس سیگنال فلورسنت ناشی از فعالیت یک آنزیم در B. atrophaeus عمل میکند.
برای استریل بخار، اندیکاتور استاندارد تمامسیکل برای «فلش استریلیزیشن» پایش قابلاعتمادی نمیدهد و اندیکاتورهای اختصاصی فلش اکنون موجود هستند.
از آنجا که شکست استریلیزاسیون ممکن است رخ دهد (برای بخار حدود ۱٪ گزارش شده)، CDC و AORN دستورالعملهایی برای برخورد با BI مثبت ارائه کردهاند. یک BI مثبت منفرد لزوماً به معنی خرابی دستگاه نیست و میتواند ناشی از تغییر مقاومت اسپور، خطای کاربری یا آلودگی آزمایشگاهی باشد. اگر شاخصهای مکانیکی و شیمیایی نشان دهند دستگاه درست کار کرده، معمولاً تست باید فوراً تکرار شود؛ اگر مثبتها ادامه داشت، استفاده از دستگاه باید متوقف و سرویس انجام شود.
درباره فراخوان اقلام (Recall)، برای اقلام غیر ایمپلنت معمولاً تنها در صورت اثبات خرابی دستگاه لازم است؛ در رویکرد محافظهکارانهتر، هر BI مثبت بهعنوان خرابی تلقی شده و اقلام از آخرین BI منفی تا چرخه بعدی با BI رضایتبخش، غیر استریل فرض و بازیابی/بازفرآوری میشوند (بهخصوص برای روشهایی غیر از بخار مانند ETO و پلاسما).
اگر اقلام قبل از بازیابی استفاده شده باشند، کارشناس کنترل عفونت باید ریسک را با همکاری CSSD/اتاق عمل/مدیریت ریسک ارزیابی کند. عوامل ارزیابی شامل نتیجه اندیکاتور شیمیایی، نتایج BIهای بعدی، پارامترهای سیکل، نمودار زمان-دما و بار میکروبی ابزارها پس از رفع آلودگی است. حاشیه ایمنی استریل بخار معمولاً زیاد است و در صورت شستوشوی مناسب و رسیدن به دما، ریسک انتقال عفونت پایین تلقی میشود؛ همچنین گزارش مستندی از انتقال بیماری با ابزار جراحیِ بازیابینشده پس از BI مثبت منتشر نشده است.
BI مثبت کاذب ممکن است به علت تست نامناسب یا اندیکاتور معیوب رخ دهد. رنگآمیزی گرم و کشت مجدد میتواند به تشخیص آلودگی کمک کند. استفاده از BIهای دو سازنده متفاوت هم میتواند برای بررسی نقص محصول مفید باشد. BI تا زمانی که تحلیل کامل نشان نداده مثبت کاذب محتمل است، نباید «کاذب» فرض شود.
بسته آزمون استاندارد برای چالش نفوذ استریلانت و حذف هوا باید استانداردسازی شود. AAMI برای بخار یک بسته ۱۶ حولهای (حدود ۱۶×۲۶ اینچ) را توصیه میکند که BI در مرکز هندسی آن قرار میگیرد (بین حوله ۸ و ۹). این بسته حدوداً ۶ اینچ ارتفاع، ۳ پوند وزن و چگالی حدود ۱۱٫۳ پوند بر فوت مکعب دارد. بسته آزمون باید در ناحیه «بدترین حالت» محفظه (معمولاً جلوی پایین نزدیک درین) گذاشته شود.
یک BI کنترلِ قرار نگرفته در معرض استریلانت باید برای تأیید زندهمانی اولیه اسپور و صحت انکوباسیون نگه داشته شود. برای ETO نیز بسته آزمون روتین وجود دارد (مثلاً BI در سرنگ پلاستیکی داخل حوله پیچیده شده و در مرکز بار قرار میگیرد).
سوابق مکانیکی/شیمیایی/بیولوژیک باید مطابق استانداردها و قوانین نگهداری شوند (مثلاً برخی استانداردها تا ۳ سال).
در اروپا، BIها معمولاً بهصورت روتین استفاده نمیشوند و آزادسازی بار بر اساس پایش مستقیم شرایط فیزیکی فرآیند انجام میشود که به آن آزادسازی پارامتریک (Parametric Release) میگویند؛ این روش نیازمند سیستم کیفیت تعریفشده و اعتبارسنجی فرآیند برای اقلام مورد استریلیزاسیون است و برای بخار، حرارت خشک و پرتو یونیزان پذیرفته شده است (مثلاً با استفاده از پروبها برای پایش دما/زمان/رطوبت در نقاط نماینده).
بازدیدهای دورهای کنترل عفونت از بخشهایی که از استریلایزر استفاده میکنند میتواند اختلافها در مهارت اپراتور، مستندسازی، نگهداری دستگاه، کیفیت بستهبندی و شمارهگذاری بار را شناسایی و اصلاح کند.
سخن پایانی
در مجموع، استریلسازی تجهیزات پزشکی یک «فرآیند زنجیرهای» است و موفقیت آن فقط به عملکرد دستگاه استریل وابسته نیست؛ بلکه از طراحی درست واحد پردازش مرکزی و جداسازی نواحی آلوده و تمیز، تا شستوشوی بهموقع و مؤثر، بستهبندی اصولی، بارگذاری صحیح، شرایط استاندارد نگهداری و نهایتاً پایش چندلایه (مکانیکی، شیمیایی و بیولوژیک) را در بر میگیرد. هر ضعف در یکی از این حلقهها میتواند نتیجه نهایی را تحتتأثیر قرار دهد و ایمنی بیمار و کارکنان را به خطر بیندازد.
بنابراین، رویکرد صحیح در مراکز درمانی، استقرار یک برنامه جامع تضمین کیفیت است که هم صلاحیت اپراتورها و رعایت دستورالعملها را پوشش دهد و هم با تأیید اولیه سیکلها، پایش مستمر و ثبت دقیق سوابق، از تکرارپذیری و یکنواختی عملکرد اطمینان حاصل کند. همچنین حرکت از «انقضای زمانمحور» به سمت «انقضای رویدادمحور» و مدیریت درست شرایط انبارش، به حفظ استریلیتی تا لحظه مصرف کمک میکند.
منبع:
CDC.Gov









